研究テーマ | Research theme
p53欠損腫瘍発症にエッセンシャルなゲノム上の特定配列mR1の同定
Identification of an essential genimic element; mR1 for p53-deficient tumor development
研究概要 | Research summary
最も普遍的ながん抑制遺伝子であるp53遺伝子の不活性化は,ほとんどすべてのヒトがんにおいて発がん機構の基盤となっています。しかし,そのp53遺伝子の正常化を目指した抗がん戦略はこれまで奏功しておりません。最近私たちは,p53遺伝子の欠損に起因する腫瘍の発症を,がん遺伝子c-Mycの遺伝子発現制御領域内に存在する特定配列;mR1に変異を入れることで,効果的に抑制できる可能性を見出しました。このmR1をターゲットにした抗がん戦略で,これまでのがん治療戦略が一変する可能性があります。
Inactivation of the p53 gene, the most universal cancer suppressor gene, is the basis of the carcinogenic mechanism in almost all human cancers. However, anticancer strategies aimed at normalizing the p53 gene have not been successful.Recently we found that mutations in mR1, a specific sequence within the regulatory region of the oncogene c-Myc, effectively suppress the development of tumors caused by deletion of the p53 gene. This mR1-targeted anticancer strategy has the potential to revolutionize previous cancer treatment strategies.
特色・研究成果・今後の展望
私たちは,骨肉腫を解析する過程で,p53遺伝子欠損に起因する骨肉腫の発症を,普遍的ながん遺伝子であるc-Myc遺伝子の発現制御領域内に存在する特定配列(mR1)に変異を入れることで,効果的に抑制できることを見出しました。
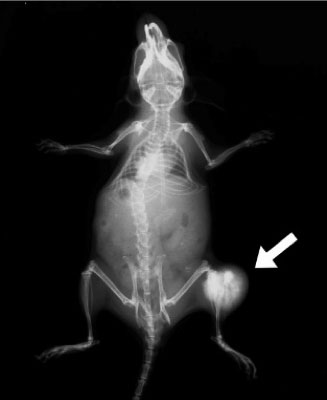
右図は解析に使用した骨肉腫発症モデルマウス「骨芽細胞特異的p53遺伝子欠損マウス」に発症した骨肉腫のレントゲン写真です(矢印は膝関節付近に発症した骨肉腫を示します)。このマウスのゲノムのmR1部位にホモ変異を導入しておくと,著しく骨肉腫の発症が抑えられることが判明しました。このmR1のDNA配列は,がん関連転写因子として知られるRUNX転写因子の特異的DNA結合配列です。これらの結果から,p53遺伝子が異常になると,RUNX転写因子がc-Myc遺伝子の異常な発現誘導をもたらし細胞を腫瘍化する,という新たな発がんメカニズムの存在が明らかとなりました。
今後は,骨肉腫のみならず,その他のがん種においても同様の効果が見られるかどうか,リンパ腫,肺がん,膵がんモデルマウスを用いてmR1変異の効果を検証していく予定です。
社会実装への展望
p53遺伝子の異常は,ほぼすべてのヒトがんで観察されるものです。よってmR1をターゲットにした創薬,すなわち,mR1へのRUNX転写因子の結合を阻害したり,mR1上のRUNX転写因子の活性を阻害できる薬剤が開発されれば,がん種を問わず普遍的に効力を示す抗がん治療が可能になります。
企業の方々へ:すでに薬剤の候補があります。開発に協力してくださる方を求めております。