研究テーマ | Research theme
消化器疾患におけるアポトーシスおよびDNA損傷応答の役割
Role of apoptosis and DNA-damage response in gastrointestinal and Liver diseases
研究者 | Researcher
赤澤 祐子
Akazawa Yuko
生命医科学域
原爆後障害医療研究所
放射線・環境健康影響共同研究推進センター
資料収集保存・解析部
生体材料保存室(原研試料室)
准教授
研究概要 | Research summary
消化器疾患における細胞死“アポトーシス”と細胞死に至るまでのシグナル伝達は,様々な疾患の原因となる重要な因子であり,発がんにも関与します。アポトーシスの起こり方の理解は治療や診断を発展させるうえで重要です。私たちは,これまで肝細胞における近年増加傾向にある非アルコール性脂肪肝炎における肝細胞のアポトーシス,胃癌の原因となるH.pyloriによる胃粘膜上皮のアポトーシス機序を解明してきました。さらに,非アルコール性脂肪肝炎において細胞が遺伝子損傷応答を行いながら生きながらえる現象が起き,遺伝子不安定性を惹起し,ひいては癌の発生に寄与する可能性を提唱しました。最近は長崎原爆被爆者における組織バンクを設立し,放射線被ばくと癌について解析を始めていいます。
Apoptosis and DNA damage response is related to various diseases in gastrointestinal and liver diseases. Our investigation has focused on role of apoptosis in hepatocytes during non-alcoholic steatohepatitis and DNA-damage response. Moreover, we have investigated role of gastric epithelial cell- apoptosis in H.pylori toxin VacA. We are currently studying if there are specific genetic signatures in colon cancer between Atomic bomb survivors.
特色・研究成果・今後の展望
メタボリック症候群は世界で増加傾向にあり,非アルコール性脂肪性肝疾患(Nonalcoholic fatty liver disease: NAFLD)はその表現型の一つです。NAFLDは肝細胞への脂肪蓄積を特徴とし,炎症を伴うと,肝炎(Nonalcoholic hepatitis; NASH) へと移行します。NASHにおける炎症,肝硬変への進展には遊離飽和脂肪酸による肝細胞アポトーシスが寄与しており,主研究者はそのメカニズムを解明してきました(Akazawa et al, J hepatol, 2010/ Am J Physiol Gastrointest Liver Physiol, 2013)。
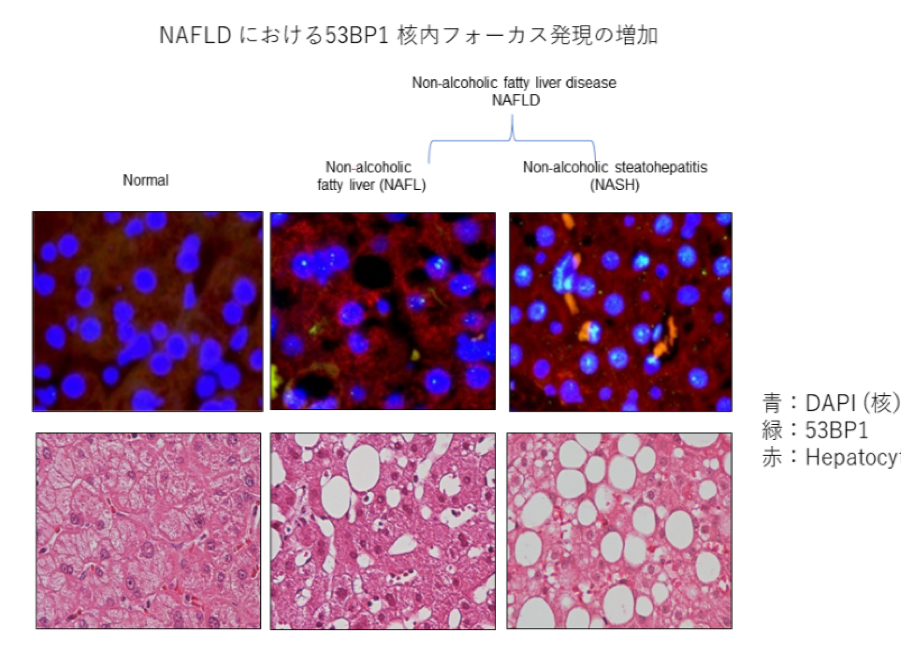
DNAの二重鎖切断はゲノム不安定性を惹起し,癌細胞への変化を誘導することが示唆されています。DNA損傷応答蛋白 (p53 binding protein-1) 53BP1はDNA二重鎖切断部位に速やかに集積します。例えば,細胞への放射線照射は,DNA二重鎖切断を誘導し,53BP1蛍光免疫染色で核内フォーカスとして検出されます。
一方,前癌病変から浸潤癌における多段階発癌過程では,放射線曝露の有無に関わらず,内因性のDNA損傷によって53BP1核内 フォーカスが形成されます。53BP1は遺伝子のいわばレスキュー隊です。しかし,遺伝子修復が正常に機能しない場合,53BP1が集積し,核内で過剰発現すると考えられ,慢性肝疾患における肝細胞DNA二重鎖切断の有無,および発癌への関与の可能性については,ほとんど検討されていませんでした。
我々の検討では,正常の肝において53BP1の異常なfocus出現は稀でしたが,NAFLD肝では有意な発現増加が見られました (0.45% vs 21.4%, normal vs NAFLD, p<0.01)。異常な53BP1の集積症例は,一般的に発癌リスクが高いとされている肝線維化が進んだ症例に多い傾向にありました。
線維化および年齢の高い症例に53BP1 large focusがより多く発現しており,これらの症例ではDNA損傷応答が惹起されていると考えられました。53BP1核内フォーカスの検討により,NAFLD患者における発がんリスクが同定でき,モニタリングの個別化に貢できる可能性があると考えられました。 (Modern pathology, Akazawa et al, 2019)
社会実装への展望
消化管のアポトーシスおよびDNA損傷応答の検討は,将来の各疾患による発癌リスクを想定することができる可能性があります。